Αλλοτροπικές τροποποιήσεις του οξυγόνου: συγκριτικό χαρακτηριστικό και τιμή
Τα άτομα ενός είδους μπορούν να είναι μέρη διαφορετικώνουσίες. Για ένα στοιχείο που χαρακτηρίζεται από το σύμβολο "O" (από το λατινικό όνομα Oxygenium), δύο κοινές απλές ουσίες είναι γνωστές στη φύση. Ο τύπος ενός από αυτούς είναι Ο2, το δεύτερο - O3. Αυτές είναι αλλοτροπικές τροποποιήσεις οξυγόνου (αλλοτρόπια). Υπάρχουν και άλλες ενώσεις που είναι λιγότερο σταθερές (Ο4 και Ο8). Η κατανόηση της διαφοράς μεταξύ αυτών των μορφών θα βοηθήσει στη σύγκριση των μορίων και των ιδιοτήτων των ουσιών.
Ποιες είναι οι αλλοτροπικές τροποποιήσεις;
Μπορούν να υπάρχουν πολλά χημικά στοιχείαδύο, τρεις ή περισσότερες μορφές. Κάθε μία από αυτές τις τροποποιήσεις σχηματίζεται από άτομα του ίδιου είδους. Ο επιστήμονας J. Berzellius το 1841 ήταν ο πρώτος που χαρακτήριζε ένα τέτοιο φαινόμενο μια αλλοτροπία. Η ανοικτή κανονικότητα αρχικά χρησιμοποιήθηκε μόνο για να χαρακτηρίσει τις ουσίες της μοριακής δομής. Για παράδειγμα, είναι γνωστές δύο αλλοτροπικές τροποποιήσεις οξυγόνου, τα άτομα των οποίων σχηματίζουν μόρια. Αργότερα, οι ερευνητές διαπίστωσαν ότι οι τροποποιήσεις μπορεί να είναι μεταξύ των κρυστάλλων. Σύμφωνα με τις σύγχρονες έννοιες, η αλλοτροπία είναι μία από τις περιπτώσεις πολυμορφισμού. Οι διαφορές μεταξύ των μορφών προκαλούνται από μηχανισμούς σχηματισμού ενός χημικού δεσμού σε μόρια και κρυστάλλους. Το χαρακτηριστικό αυτό εκδηλώνεται κυρίως στα στοιχεία των ομάδων 13-16 του περιοδικού πίνακα.

Πώς ένας διαφορετικός συνδυασμός ατόμων επηρεάζει τις ιδιότητες της ύλης;
Αλλοτροπικές τροποποιήσεις οξυγόνου και όζοντοςσχηματίζονται από τα άτομα του στοιχείου με τον αριθμό σειράς 8 και τον ίδιο αριθμό ηλεκτρονίων. Αλλά διαφέρουν στη δομή, η οποία προκάλεσε σημαντική διαφορά στις ιδιότητες.
| Συμπτώματα | Οξυγόνο | Όζον |
Σύνθεση του μορίου | 2 άτομα οξυγόνου | 3 άτομα οξυγόνου |
| Δομή | 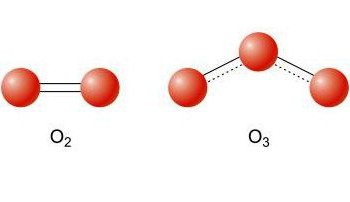 | |
| Συνολική κατάσταση και χρώμα | Άχρωμο διαφανές αέριο ή ανοιχτό μπλε υγρό | Μπλε αέριο, μπλε υγρό, σκούρο μωβ στερεό |
| Οσμή | Λείπει | Ξαφνική, που θυμίζει κεραυνό, φρεσκοκομμένο σανό |
Σημείο τήξης (° C) | -219 | -193 |
| Σημείο ζέσεως (° C) | -183 | -112 |
Πυκνότητα (g / l) | 1,4 | 2,1 |
Διαλυτότητα στο νερό | Ελαφρώς διαλυτό | Καλύτερα από το οξυγόνο |
Χημική δραστηριότητα | Υπό κανονικές συνθήκες, σταθερό | Είναι εύκολο να αποσυντεθεί με το σχηματισμό οξυγόνου |
Συμπεράσματα σχετικά με τα αποτελέσματα της σύγκρισης: το οξυγόνο αλλοτροπικός τροποποιήσεις δεν διαφέρουν στην ποιοτική σύνθεση. Η δομή του μορίου αντικατοπτρίζεται στις φυσικές και χημικές ιδιότητες των ουσιών.
Είναι η ίδια ποσότητα οξυγόνου και όζοντος στη φύση;
Μια ουσία της οποίας ο τύπος O2, εμφανίζεται στην ατμόσφαιρα, υδροσφαιρία, επίγειαφλοιός και ζωντανούς οργανισμούς. Περίπου το 20% της ατμόσφαιρας σχηματίζεται από μόρια διατομικού οξυγόνου. Στη στρατόσφαιρα σε υψόμετρο περίπου 12-50 χλμ. Από την επιφάνεια της γης υπάρχει μια στρώση που ονομάζεται "οθόνη όζοντος". Η σύνθεσή του αντικατοπτρίζει τον τύπο Ο3. Το όζον προστατεύει τον πλανήτη μας απορροφώνταςεπικίνδυνες ακτίνες του κόκκινου και του υπεριώδους φάσματος του Ήλιου. Η συγκέντρωση της ουσίας μεταβάλλεται συνεχώς και η μέση τιμή της είναι χαμηλή - 0,001%. Έτσι, O2 και Ο3 - αλλοτροπικές τροποποιήσεις του οξυγόνου, οι οποίες παρουσιάζουν σημαντικές διαφορές στη φύση τους.
Πώς να πάρει οξυγόνο και όζον;
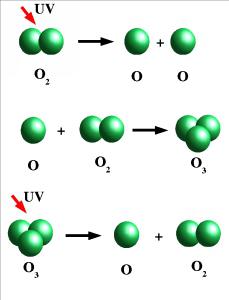
Αλλοτροπικές τροποποιήσεις οξυγόνου και θείου
Τα χημικά στοιχεία O (Oxygenium) και S (Sulfur)βρίσκονται στην ίδια ομάδα του περιοδικού πίνακα, χαρακτηρίζονται από τον σχηματισμό αλλοτροπικών μορφών. Από μόρια με διαφορετικούς αριθμούς ατόμων θείου (2, 4, 6, 8) κάτω από κανονικές συνθήκες, ο πιο σταθερός είναι το S8, που μοιάζει με κορώνα σε σχήμα. Το ρομβικό και μονοκλινικό θείο κατασκευάζονται από τέτοια μόρια 8 ατόμων.


Σε βιομηχανική κλίμακα,οξειδωτικές ιδιότητες των διαφόρων μορφών. Το όζον χρησιμοποιείται για την απολύμανση του αέρα και του νερού. Ωστόσο, σε συγκεντρώσεις άνω των 0,16 mg / m3, το αέριο αυτό είναι επικίνδυνο για ανθρώπους και ζώα. Το μοριακό οξυγόνο είναι απαραίτητο για την αναπνοή, χρησιμοποιείται στη βιομηχανία και στην ιατρική. Ένα σημαντικό ρόλο στην οικονομική δραστηριότητες παίζουν αλλότροπο του άνθρακα (διαμαντιού, γραφίτης), φωσφόρος (λευκό, κόκκινο) και άλλα χημικά στοιχεία.










