Τι είναι η αλλοτροπία; Αλλοτροπία άνθρακα, χημεία
Λόγοι για την ποικιλία των οργανικών ενώσεων -η ικανότητα των ατόμων άνθρακα να σχηματίσουν διάφορες αλυσίδες και κύκλους, που συνδέονται μεταξύ τους. Αυτό είναι το φαινόμενο του ισομερισμού. Και ποιος είναι ο λόγος για την ποικιλία απλών ανόργανων ουσιών; Αποδεικνύεται ότι αυτή η ερώτηση μπορεί να απαντηθεί εξετάζοντας ποια είναι η αλλοτροπία. Με αυτό το φυσικό φαινόμενο στον κόσμο των χημικών στοιχείων συνδέεται η ύπαρξη διαφόρων μορφών απλών ενώσεων.
Τι είναι η αλλοτροπία;
Μπορείτε να απαντήσετε σε αυτήν την ερώτηση με τον ακόλουθο τρόπο. Αυτό το φαινόμενο της ύπαρξης του ίδιου χημικού στοιχείου με τη μορφή αρκετών απλών ουσιών. Δηλαδή, αν τα κύτταρα στον περιοδικό πίνακα 118, αυτό δεν σημαίνει ότι υπάρχουν πολλά άτομα στη φύση. Κάθε ένα από τα στοιχεία (σχεδόν όλα) έχει μία ή περισσότερες ποικιλίες ή αλλοτροπικές τροποποιήσεις.
Ποια είναι η διαφορά μεταξύ αυτών των ουσιών; Οι λόγοι αυτού του φαινομένου είναι δύο κύριοι:
- διαφορετικός αριθμός ατόμων στο μόριο (σύνθεση αλλοτροπίας).
- άνιση δομή του κρυσταλλικού πλέγματος (μορφή αλλοτροπίας).
Συχνά αυτή η έννοια συνδέεται με τον όρο.πολυμορφισμό. Ωστόσο, υπάρχει μια διαφορά μεταξύ τους. Τι είναι η αλλοτροπία; Αυτές είναι τροποποιήσεις ενός χημικού στοιχείου σε διάφορες απλές ουσίες, ανεξάρτητα από την κατάσταση της συνάθροισης. Ενώ ο πολυμορφισμός είναι μια έννοια που ισχύει μόνο για στερεές κρυσταλλικές ουσίες.
Διάφορες αλλοτροπικές τροποποιήσεις των ενώσεωνείναι αποδεκτό να υποδεικνύονται με λατινικά γράμματα πριν από το όνομά τους. Το Alpha τοποθετείται πάντα πριν από τη φόρμα που έχει το χαμηλότερο σημείο τήξης, το σημείο βρασμού. Περαιτέρω με αλφαβητική σειρά και αύξηση των δεικτών, αντίστοιχα.
Αν και το χημικό στοιχείο στη βάσηοι απλές ουσίες είναι οι ίδιες, οι ιδιότητες των τροποποιήσεων είναι σημαντικά διαφορετικές μεταξύ τους, τόσο φυσικές όσο και χημικές. Η απλούστερη μορφή αλλοτροπικών μορφών:
- μη μεταλλικά (εκτός από αλογόνα και αδρανή αέρια).
- semimetals.
Η αλλοτροπία των μετάλλων έχει μελετηθεί ελάχιστα, δεδομένου ότιΔημιουργούν τέτοιες τροποποιήσεις απρόθυμα και όχι όλες. Συνολικά, σήμερα είναι γνωστές περισσότερες από 400 διαφορετικές μορφές απλών ουσιών. Όσο περισσότερες καταστάσεις οξείδωσης είναι χαρακτηριστικές για ένα στοιχείο, τόσο μεγαλύτερος είναι ο αριθμός των αλλοτροπικών τροποποιήσεων που είναι γνωστά σε αυτό.

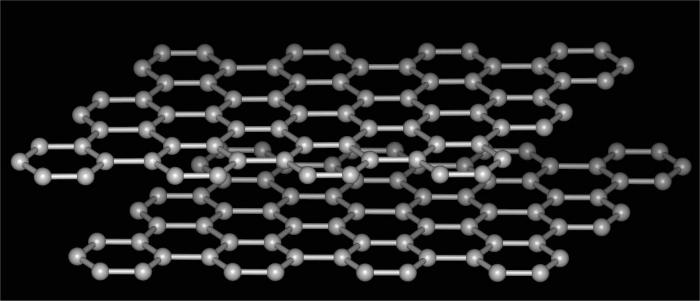
Τροποποιήσεις άνθρακα
Η αλλοτροπία του άνθρακα είναι η πιο κοινήκαι ένα ζωντανό παράδειγμα που απεικονίζει το εξεταζόμενο φαινόμενο. Μετά από όλα, αυτό το στοιχείο είναι ικανό να σχηματίσει διάφορους τύπους ενώσεων που διαφέρουν στη δομή του κρυσταλλικού πλέγματος. Ταυτόχρονα, οι απλές ουσίες που σχηματίζονται είναι τόσο πολικές στις ιδιότητές τους, που μένει μόνο να εκπλαγούν με τις αποφάσεις της φύσης.
Έτσι, η αλλοτροπία άνθρακα περιλαμβάνει τις ακόλουθες τροποποιήσεις.
- Αυτό που μπορεί να εντοπιστεί είναι η αλλοτροπία του άνθρακαστην παρακάτω φόρμα, η οποία είναι εντελώς διαφορετική από την προηγούμενη. Αυτός είναι ο γραφίτης. Μια πολύ απαλή ουσία που μπορεί εύκολα να αποκολληθεί και να αφήσει ένα χαρακτηριστικό σημάδι στο χαρτί. Ως εκ τούτου, χρησιμοποιείται για την κατασκευή των μαρκαδόρων πλάκα απλή. Η δομή αυτής της μορφής είναι στρώση εξαγωνική. Οι συνδέσεις μεταξύ των στρωμάτων είναι αδύναμες, εύκολα σπασμένες, η πυκνότητα της ουσίας είναι χαμηλή. Ο γραφίτης χρησιμοποιείται για την παραγωγή συνθετικών διαμαντιών, ως στερεού λιπαντικού, για την κατασκευή ηλεκτροδίων, ως πληρωτικό για πλαστικά, καθώς και σε πυρηνικούς αντιδραστήρες.
- Fullerenes - μια άλλη απόδειξηυπάρχει αλλοτροπία. Η χημεία αυτών των ενώσεων είναι παρόμοια με εκείνη των αρωματικών υδρογονανθράκων. Μετά από όλα, η δομή τους αντιπροσωπεύεται από κυρτό κλειστό πολύεδρα που μοιάζει με μπάλα ποδοσφαίρου. Τα φουλερένια χρησιμοποιούνται στην τεχνολογία ως ημιαγωγός, για την παραγωγή υπεραγώγιμων ενώσεων, ως φωτοευαίσθητα υλικά κ.ο.κ.
- Lonsdaleite και cerafit - δύο ακόμα κρυσταλλικάαλλοτροπικές τροποποιήσεις άνθρακα. Άνοιξε σχετικά πρόσφατα. Οι ιδιότητες είναι πολύ παρόμοιες με το διαμάντι, απουσία ακαθαρσιών μπορεί να είναι ακόμη μερικές φορές πιο σκληρές.
- Ο άνθρακας και η αιθάλη είναι άμορφη αλλοτροπία ουσιών. Χρησιμοποιείται ως καύσιμο, λιπαντικά, φίλτρα και ούτω καθεξής. Σύμφωνα με το περιεχόμενο στη φύση, το πιο συνηθισμένο από όλες τις τροποποιήσεις άνθρακα.

Diamond
Το πιο δύσκολο από όλα τα γνωστά σήμεραπου εκτιμώνται σε 10 σημεία στην κλίμακα Mohs. Η κρυσταλλική μορφή του άνθρακα, η δομή του οποίου έχει τη μορφή τετραεδρικών σχηματισμών σωστά διασυνδεδεμένων σε ένα δίκτυο.
Ένα διαμάντι είναι πολύ καλό στη διάχυση του φωτός, το οποίοσας επιτρέπει να το χρησιμοποιήσετε ως κοσμήματα (διαμάντια). Λόγω της εξαιρετικής σκληρότητας του, χρησιμοποιείται για κοπή και συγκόλληση, διάτρηση, στίλβωση και λείανση. Σήμερα, έχει δημιουργηθεί η παραγωγή τεχνητών διαμαντιών που χρησιμοποιούνται στη βιομηχανία.
Άλλες ποικιλίες
Υπάρχουν επίσης διάφορες άλλες παραλλαγές αυτού του στοιχείου:
- νανοσωλήνες;
- νανοπένια;
- αστρολίνες;
- νανοί;
- άνθρακας από γυαλί.
- graphene;
- carbin;
- nanopochki.
Οι ανεπιβεβαίωτες αλλά υποτιθέμενες μορφές ύπαρξης απλών ενώσεων άνθρακα: χαιώδες, μεταλλικό άνθρακα και δι-άνθρακα.

Αλλοτροπία οξυγόνου
Αυτό το μη μέταλλο σχηματίζει δύο απλές ουσίες:
- οξυγόνο (υπό κανονικές συνθήκες) του οποίου ο τύπος είναι Ο2.
- αέριο όζον, μια εμπειρική αντανάκλαση της σύνθεσης της οποίας είναι το Ο3.
Προφανώς, ο κύριος λόγος για αυτό είναιύπαρξη τροποποιήσεων - τη σύνθεση του μορίου. Το κανονικό οξυγόνο είναι η βάση της ζωής για όλα τα ζωντανά (με εξαίρεση τα αναερόβια βακτήρια). Είναι ενεργός συμμετέχων στην ανταλλαγή αερίων, πηγή ενέργειας για όλες τις διαδικασίες ζωής. Χημικά, είναι ένας παράγοντας οξείδωσης, μέσω του οποίου διεξάγονται πολλές αντιδράσεις.
Το όζον σχηματίζεται στη φύση ή το ιδιαίτεροεργαστηριακές εγκαταστάσεις οζονιστές από οξυγόνο αέρα υπό τη δράση μιας ισχυρής απόρριψης ηλεκτρικής ενέργειας. Σε φυσικές συνθήκες - αυτό είναι αστραπή. Στις χαμηλές διάχυτες συγκεντρώσεις έχει μια ευχάριστη οσμή φρεσκάδας (μετά από μια καταιγίδα είναι πάντοτε αισθητή στον αέρα). Είναι ένας πολύ ισχυρός οξειδωτικός παράγοντας, λευκαντικό, χημικά ενεργό.

Τροποποιήσεις φωσφόρου
Η αλλοτροπία του οξυγόνου είναι παρόμοια με εκείνη του φωσφόρου. Έχει επίσης περίπου 11 διαφορετικές τροποποιήσεις, που διαφέρουν στον αριθμό των ατόμων στο μόριο, και ως εκ τούτου, χημική σύνδεση και ιδιότητες. Υπάρχουν τρεις σταθερές μορφές και οι υπόλοιπες, στη φύση, σχεδόν ανύπαρκτες και αποσυντίθενται.
- Λευκός φωσφόρος. Ο τύπος του είναι P4. Μια ουσία που μοιάζει με μαλακή παραφίνη λευκό ή ελαφρώς κιτρινωπό. Λιώνει εύκολα, μετατρέπεται σε δηλητηριώδες αέριο.
- Ο ερυθρός φώσφορος είναι μια μάζα πάστας με δυσάρεστη οσμή. Φόρμουλα - Ρn. Αυτή είναι μια πολυμερής δομή.
- Ο μαύρος φώσφορος είναι μια μαζική λιπαρή ουσία στην αφή, η οποία έχει μαύρο χρώμα και δεν διαλύεται καθόλου στο νερό.
Μεταλλικές τροποποιήσεις
Τι είναι η αλλοτροπία των μετάλλων, μπορεί να βρεθεί στο παράδειγμα του σιδήρου. Υπάρχει στη μορφή:
- άλφα;
- βήτα.
- γ.
- sigma forms
Καθένα διαφέρει από την προηγούμενη δομή του κρυσταλλικού πλέγματος και, κατά συνέπεια, από τις ιδιότητές του. Για παράδειγμα, η μορφή άλφα είναι σιδηρομαγνητική και η βήτα παραμαγνητική.
Γενικά, από όλα τα γνωστά μέταλλα, οι αλλοτροπικές τροποποιήσεις αποτελούν συνολικά 27 χημικά στοιχεία.

Χλωρίδα αλλοτροπίας
Ενδιαφέρουσα επειδή η φόρμα άλφα είναι γκρίζασκόνη που υπάρχει μόνο σε χαμηλές θερμοκρασίες. Το βήτα, από την άλλη πλευρά, είναι μεταλλικό, ασημένιο λευκό, μαλακό και πλαστικό. Υπάρχει σε υψηλές θερμοκρασίες - μέχρι 161 oΓ. Μια μορφή μετατρέπεται εύκολα σε άλλη σε φυσικές συνθήκες, εάν υπάρχει διαφορά βαθμού.








